Ұйқы бездік жеткіліксіздік кезіндегі алмастыру ферменттік терапия
И. В. Маев, профессор, м.ғ.д Ю. А. Кучерявый, м.ғ.к.
МММСУ ішкі аурулар пропедевтикасы және гастроэнтерология кафедрасы
(каф. кафедра меңгерушісі проф. И. В. Маев)
Экзокринді ұйқы бездік жеткіліксіздікті емдеу әлі күнге дейін күрделі мәселе болып қалады, бұл оның патогенезінің көп факторлығымен және терапияның оңтайлы схемасын немесе неғұрлым тиімді препаратты таңдау күрделілігімен түсіндіріледі. Мақалада экзокриндік жеткіліксіздік дәрежесін, асқазан қышқыл түзілу деңгейін, аш ішектің бактериялық контаминациясын және т. б. ескере отырып, әрбір пациентке жеке көзқарас қажеттілігін көрсететін орынбасушы ферменттік терапияның патофизиологиялық және фармакологиялық аспектілері берілген. Соңғы жылдары әзірленген ферменттік препараттардың галениялық нысандары, протеаз бен липазаның олардың субстраттарына тікелей араласуы мен сегрегациясын айтарлықтай жақсартатын, ұйқы бездік жеткіліксіздік кезінде алмастыру терапиясының сапасын едәуір арттырады. Препаратты асқазандағы тұз қышқылынан қорғайтын қабықпен қапталған таблеткаланған полиферментті препараттарды қолдану іс жүзінде пайдасыз; тек энтеросолюбильді қабықпен қапталған панкреатиннің минимикросфералары бар соңғы ұрпақтың препараттары стеатореяны анық және мөлшерге тәуелді азайтады. Дәрігер алмастырушы ферменттік терапия принциптерін білуі тағайындалған емнің барабарлығын және ауру ағымының болжамын анықтайды.
Түйінді сөздер: ұйқы безінің жетіспеушілігі, созылмалы панкреатит, емдеу, панкреатин
Ұйқы безінің (ҰБ) сыртқы секреторлы жеткіліксіздігінің синдромы атрофия, фиброз, неоплазия нәтижесінде оның жұмыс істеп тұрған экзокринді паренхимасы массасының азаюымен немес ҰБ шығару жолдарының конкрементпен, ісікпен, қою және тұтқыр сөлмен бұғатталуына байланысты аш ішекке (ОЕЕІ) ұйқы бездік сөлдің кетуінің бұзылуымен байланысты. Сонымен қатар, ұйқы бездік ферменттер белсендірілмеген немесе ішекте әсерсіздендірілген қайталама ұйқы бездік жетіспеушілікті бөледі (1-кесте). Холецистокин мен секретинді секретациялайтын I-жасушалар мен S-жасушалардың саны азайған кезде аш ішектің сілемейлі проксимальді бөлімінің атрофиялық өзгерістерінің дамуы маңызды мәнге ие. Эндогенді секретин тапшылығы асқорыту ағзаларының бірқатар функцияларының бұзылуын тудырады: ОЕЕІ-те және ұйқы бездік түтіктерде қысым артады, Одди қысқышының құрысуы байқалады, ұйқы бездік шырынның және бикарбонаттардың көлемі төмендейді. Нәтижесінде ұйқы бездік шырынның сұйық бөлігінің секрециясы азаяды, бұл оның қоюлануына және ақуыз концентрациясының жоғарылауына, демек, тұтқырлықтың ұлғаюына және секреттің ағу жылдамдығының төмендеуіне әкеледі.
ҰБ экзокриндік жетіспеушілігінің клиникалық манифестациясы гастринтестиналдық моториканың, асқазан, билиарлы және жіңішке ішек безінің секрециясының, абсорбцияның, гормондардың секрециясының және абдоминалдық хирургияның салдарларының (асқазанды резекциялаудан және гастрэктомиядан, холецистэктомиядан, билиодигестивті шунттеуден кейінгі жай-күй және т.б.) ерекшеліктерін қамтитын қайталама факторларға байланысты. Жоғарыда көрсетілген бұзушылықтарды түзету сыртқы секреторлық ұйқы бездік жеткіліксіздіктің көріністерін азайтуға ғана емес, оны толық тоқтатуға да ықпал ете алады. Сондықтан көптеген авторлар ҰБ экзокриндік жеткіліксіздігін бастапқы және қайталама деп бөлуді қалайды. Бірқатар жағдайларда қайталама ұйқы бездік жетіспеушілік ҰБ экзокринді функциясының сақталуы аясында да, сондай-ақ бастапқы сыртқы құпия жеткіліксіздіктің фонында да дами алатынын атап өткен жөн.
1-кесте
Ұйқы бездік жетіспеушіліктің себептері
Бастапқы
ұйқы бездік жеткіліксіздік
Қайталама
ұйқы бездік жеткіліксіздік
– Созылмалы панкреатит
– Муковисцидоз
– Ересектердің ҰБ липоматозы (семіздік кезінде)
– ПЖ резекциясы, панкреатэктомия
– Липазаның оқшауланған жеткіліксіздігі
– Швахман Синдромы
– Йохансон-Близзард Синдромы
– Агенезия, ҰБ гипоплазиясы
– ҰБ обыры
– кетуді бұзбай жұмыс істейтін паренхиманы субтоталды алмастырумен инфильтративті өсу
- негізгі ұйқы бездік ағынның блок дамуымен (өсу, қысылу) ҰБ-нің жергілікті зақымдануы
- Аш ішектің шырышты қабығының аурулары (ҰБ секретинді және холецистокининді ширықтырудың азаюы)
– Гастринома (ҰБ ферменттерінің әсерсіздендірілуі)
- Бильрот II бойынша Анастомоз (ҰБ ферменттерінің тағамдық түйірмен нашар араласуы)
- Энтерокиназаның туа біткен жеткіліксіздігі
- Тамақтан ақуыздардың түсуінің жеткіліксіздігі
- Өт-тас ауруы, холецистэктомиялық синдром, бауыр циррозы (өт қышқылдарының жетіспеушілігі, ОЕЕІ-ке өт және ұйқы бездік шырынның түсу асинхронизмі)
Алмастырушы ферменттік терапияның патофизиологиялық аспектілері. ҰБ ферменттер секрециясының үлкен резервтік мүмкіндігі бар, өйткені физиологиялық жағдайда ол тәулігіне екі литр ұйқы бездік шырынды шығарады, онда 10 есе көп ферменттер мен зимогендер бар, тағамның қалыпты қорытылуы (физиологиялық гиперсекреция) үшін талап етілгеннен (физиологиялық гиперсекреция) алынады [13,16]. Демек, мальабсорбция синдромын дамыту үшін секреторлық мүмкіндік физиологиялық гиперсекреция шамасынан шамамен 5-10% деңгейге дейін, немесе басқаша айтқанда, "нормадан" айтарлықтай төмендеуі тиіс, бұл эксперименталды және клиникалық зерттеулерде көрсетілген [13,19,22,26].
Бір қарағанда, ҰБ сыртқы құпия жеткіліксіздігі бар науқастарда пайда болатын мальабсорбция синдромын емдеу өте қарапайым көрінеді. Шынында да, экзогенді ұйқы бездік ферменттерді ауыстыру мақсатында қарапайым ауызша қабылдау өте тиімді болуы керек. Алайда, ұйқы бездік жеткіліксіздіктің клиникалық көріністерін толық түзетуге жиі қол жеткізілмейді, бұл, талдауын біз төменде ұсынған көптеген түрлі факторларға байланысты.
ҰБ экзокриндік жеткіліксіздігіне әкелетін әртүрлі нозологиялардың кең спектріне қарамастан, бұл синдромның дамуының ең жиі себебі созылмалы панкреатит (СП) болып табылады. Сыртқы секреторлық жетіспеушіліктің патогенезі СП кезінде зерттелген, бұл СП жиі кездесулерімен ғана емес, сонымен қатар ҰБ обырымен, тұқым қуалайтын аурулармен және даму ауытқуларымен, ҰБ оперативтік араласудан кейінгі жағдайлармен салыстырғанда ағымның салыстырмалы қолайлы болжамымен байланысты. Сондықтан да осы мақалада біз СП науқастарындағы ҰБ-ның сыртқы секреторлы жеткіліксіздігі туралы басым түрде айтатын боламыз.
СП ұзақтығының ұлғаюына қарай ферменттердің секрециясы одан да азаюда, липазаның тапшылығы көп дәрежеде байқалады және трипсин тапшылығынан бұрын дамиды. Бұл келесідей түсіндірілуі мүмкін:
- СП науқастарында бірінші кезекте липазаның ұйқы бездік секрециясы төмендейді, ал кейіннен амилаза және протеаз секрециясы төмендейді [14,16], алайда бұл бұзылулардың себептері әлі күнге дейін анық емес деп саналады .
- Липаза амилазамен және протеаздармен салыстырғанда көп жағдайда протеолитикалық гидролизбен әсерсіздендіріледі [28,30].
- Ұйқы бездік протеаздардың жеткіліксіздігі ішек протеаздарымен және пептидаздармен, ұйқы бездік амилазалар – сілекей мен ішектің амилазаларымен өтелуі мүмкін. Сілекей және асқазан липазасының компенсаторлық мүмкіндіктері басқа ұйқы бездік ферменттерге қарағанда айтарлықтай төмен және стеатореяның пайда болуын болдырмауы мүмкін [29,38,45].
- ҰБ экзокринді жеткіліксіздігінде ұйқы бездік ферменттер синтезінің төмендеуімен қатар бикарбонаттар секрециясының төмендеуі байқалады,бұл ОЕЕІ-тегі рН деңгейінің ұдемелі құлдырауына әкеледі. 5,0-ден төмен рН кезінде липаза, басқа ферменттерге қарағанда тезірек жойылады. Сонымен қатар, интрадуоденальді рН төмендеген кезде өт қышқылдарының преципитациясы төмендейді, мицеллдің қалыптасуы бұзылады, соның салдарынан май сіңуі қосымша бұзылады [44,45].
Бұрын талқыланғандай, ОЕЕІ-ке липазаның ферменттің қалыпты концентрациясынан 5-10% - дан асатын экзогенді түсуі стеаторея редукциясымен бірге жүруі тиіс [37]. Алайда, пациенттердегі экспериментте ҰБ экзокриндік жеткіліксіздігінің түзетілуіне, ОЕЕІ-тегі липаза концентрациясымен ғана анықталып, қабылданатын препаратқа және оның мөлшеріне қарамастан қол жеткізілді [23,43]. Бұл тұз қышқылының гиперсекрециясымен және аш ішектің жарығында ферменттердің әсерсіздендірілуімен байланысты болды деп болжауға болады [31]. Осылайша, ферменттерді ішке қабылдағаннан кейін едәуір белсенді трипсин асқазандағы және ОЕЕІ-тегі рН төмен мәндерінің жағымсыз әсеріне қарсы тұрады. Сондықтан жеткілікті мөлшерде қабылданған панкреатиннің кез келген препараты (ас қорыту кезеңінің 4 сағ ішінде секрецияланатын ең көп мөлшерінің 10%-нан астам) азотореяны жояды, бірақ стеатореяны емес. Мұндай жағдайларда стеаторея әрдайым азаяды, бірақ егер науқаста қосымша ахлоргидрия болмаса, жоғалмайды [3]. Алайда, алмастырушы ферменттік терапияға антисекреторлық құралдарды қосқан кезде (аш ішекте рН мәнін арттыру мақсатында) стеатореяда науқастардың 40% - ында жоғалады [36].
Осылайша, СП кезінде стеатореяның дамуы ұйқы бездік липазаның синтезінің төмендеуі нәтижесінде ұйқы бездік липолиздің бұзылуымен, ОЕЕІ ацидификациясы бар бикарбонаттар секрециясының бұзылуымен және өт қышқылдарының преципитациясымен байланысты.
Полиферментті препараттардың қысқаша сипаттамасы.
Полиферментті препараттар-бұл, негізгі әсер етуші субстраты таза түрдегі немесе қосымша компоненттермен (өт қышқылдары, гемицеллюлоза, симетикон, адсорбенттер және т.б.) біріктірілген панкреатин болып табылатын, аралас көп компонентті дәрілік заттар, негізінен жануар тектес [5].
Қазіргі уақытта фармакологиялық нарық құрамы мен клиникалық әсері бойынша әртүрлі полиферментті препараттарға өте бай, алайда олардың негізгі компоненті протеазасы, липазасы және амилазасы бар ҰБ сығындысы - панкреатин болып табылады. Полиферментті препараттарды олардың құрамына кіретін компоненттердің комбинациясына байланысты бірнеше топқа бөлуге болады [8, 5, 10]:
- Негізгі әсер етуші заты пепсин (абомин, пепсидил, ацидинпепсин) болып табылатын, асқазанның шырышты қабығының сығындылары.
- құрамына амилаза, липаза және трипсин (панкреатин, панцитрат, мезим-форте, креон, ликреаза және т.б.) кіретін ұйқы бездік энзимдер.
- Құрамында панкреатиннен басқа өт компоненттері, гемицеллюлаза, симетикон және т.б. бар құрамдастырылған препараттар (фестал, дигестал, панстал, энзистал, панкреофлат және т. б.).
- Өсімдік тектес энзимдерімен, дәрумендермен (вобэнзим), комбицин (панкреатин және күріш саңырауқұлақ сығындысы) үйлескен құрамында жануарлар тектес ферменттері (панкреатин) бар біріктірілген ферменттер.
- Папаинмен, зеңдік амилазамен, протеазамен, липазамен және басқа ферменттермен ұсынылған, негізгі өсімдік тектес энзимдер (пепфиз, ораза).
- Құрамында лактазасы бар ферменттер (лактраза, тирактаза).
Панкреатиттермен ауыратын науқастарда ферменттердің бірінші тобын қолдану ҰБ ауыр сыртқы секреторлы жетіспеушілігіктің және атрофиялық гастриттің ұштасқан кезінде ғана көрсетілген. 2-4 топтағы препараттарда жануарлар тектес панкреатині бар, бірақ әр түрлі құрамға және тиісінше фармакологиялық әсерге байланысты олар өзара алмастырылмайды және қолдануға анық көрсеткіштері бар.
Біздің ойымызша, мальдигестия және мальабсорбция синдромдары кезінде ас қорытуды қалыпқа келтіретін ең әмбебап құралдар асқазан, бауыр, билиарлық жүйе және ішек моторикасына әсер етпейтін панкреатин препараттары болып табылады. Бұл ферменттер ас қорыту белсенділігінің жеткілікті спектрін қамтамасыз етеді және жүрек айнуы, іштегі қорылдау, метеоризм, стеато-, креато - және амилорея сияқты клиникалық белгілерді тоқтатуға көмектеседі. Полиферментті кешенге кіретін амилаза өсімдік клетчаткасының гидролизіне қатыспай, көбінесе жасушадан тыс полисахаридтерді қарапайым қанттар - сахарозалар мен мальтоздарға дейін ыдыратады. Панкреатин препараттарындағы протеаздар негізінен химотрипсинмен және трипсинмен көрсетілген. Липаза бейтарап майдың гидролизіне қатысады.
Құрамдастырылған препараттар құрамында панкреатинмен бірге өт қышқылдары, гемицеллюлаза, симетикон, өсімдік тектес өт айдайтын заттарды және т. б. қамтиды. Препаратқа өт қышқылын енгізу оның ас қорыту безінің функциясына және асқазан-ішек жолының моторикасына әсерін айтарлықтай өзгертеді. Ұйқы безінің секрециясы мен тырысқақ артады, ішек және өт қабының моторикасы ынталандырылады. Ішектің микробтық контаминациясы жағдайында олардың деконъюгациясы болады, бұл кейбір жағдайларда осмотикалық және секреторлық іш өтудің дамуына ықпал етеді. Олар ҰБ секрециясын арттыратындықтан, ішектің перистальтикасын және өт қабының моторикасын ынталандыратындықтан, ішек ішілік осмотикалық қысымды, демек, ауырсыну абдоминальды синдромын, арттыратындықтан, құрамында өт қышқылдары бар ферментті препараттар СП ісінген және ауырсынатын нысандары бар науқастарға қарсы көрсетілетінін есте сақтау қажет.
Сыртқы секреторлы жеткіліксіздігі бар СП кезіндегі алмастырушы ферментті терапияға көрсеткіштер [7]:
- нәжіспен тәулігіне 15 г-нан артық май жоғалғандағы стеаторея;
- үдемелі трофологиялық жетіспеушілік;
- тұрақты диареялық синдром және диспептикалық шағымдар.
Алмастырушы полиферментті терапияның фармакологиялық аспектілері. Ұйқы бездік ферменттермен алмастыру терапиясының негізгі мақсаты ОЕЕІ ішіндегі липазаның жеткілікті белсенділігін қамтамасыз ету болып табылады. Тұз қышқылының ұйқы безінің ферменттеріне әсері олардың санының 90%-ға дейін бұзылуына әкелетіні белгілі, сондықтан, асқазанның қышқылдық барьерін жеңу арқылы полиферментті препараттардың қышқылға төзімді қабықтағы галеникалық формаларын құру пайда болды. Мұндай қабығы бар препаратты қолдану майлардың сіңуін қабықсыз панкреатиннің салыстырмалы мөлшерімен салыстырғанда орта есеппен 20% - ға арттырады [27].
Егер асқазандағы тамақтан кейінгі рН секрецияның жеке ерекшеліктеріне, сондай-ақ тамақ мөлшеріне және оның асқазанда болу уақытына байланысты болса, онда аш ішектің қуысында болатын (интрадуоденальды) рН ҰБ бикарбонаттарының қалдық секрециясына, аш ішектің бикарбонаттарының секрециясына, көлемнің сұйылуынан, сондай-ақ тұз және өт қышқылдарының мөлшеріне байланысты. Сондықтан, ұйқы безінің ферменттерінің қышқылға төзімді формаларын пайдалану екі маңызды жағдайды қояды – интрагастральды рН 5-тен аспауы тиіс, себебі бұл жағдайда ферменттер энтеросолюбильді қабықтан асқазанда босатылатын болады. Егер бұл орын алса, онда мотор функциясы бұзылған пациенттерде ферменттердің бір бөлігі реацидификация кезінде біржола жойылатын болады. Екінші жағынан, ұйқы бездік ферменттердің асқазан ішілік босатылуы эрозивті-жаралы зақымдануларын тудырып, агрессия факторларының күшеюіне қарай асқазанның шырышты қабығын қорғау балансын жылжытуы мүмкін. Бұл механизм өт қышқылдарының, лизолицетиннің және фосфолипаздың шырышты асқазанға теріс әсері есебінен дербес агрессивті фактор болып табылатын дуоденогастральды рефлюксі бар пациенттерде жиі іске асырылады. Сонымен қатар, интрадуоденальды рН ОЕЕІ-те ферменттерді барабар босату үшін 5,5-тен төмен болмауы тиіс.
Тиімді алмастырушы ферменттік терапияны жүргізуді қиындататын маңызды фактор - ферменттік препараттар мен тағамдық түйірдің асинхронды гастродуоденалды қозғалысы болып табылады, ол пассаждың бұзылуы кезінде (қант диабеті, қалтқы стенозы, ваготомиядан кейінгі жағдайы, автономды нейропатия және т.б.), сондай-ақ ферменттік препараттарды салыстырмалы түрде үлкен мөлшерде қолданғанда байқалады.
Көптеген ферменттік препараттар ішекте еритін қабықтардағы драже немесе таблетка түрінде шығарылады, бұл ферменттерді асқазанда босатудан және асқазан сөлінің тұз қышқылынан бұзылудан қорғайды. Көптеген таблеткалардың немесе драженің өлшемі 5 мм және одан да көп болып келеді. Дегенмен, асқазаннан тамақпен бір мезгілде диаметрі 2 мм-ден аспайтын, оңтайлы мөлшерде 1,4 мм болатын қатты бөлшектер көшірілуі мүмкін екендігі белгілі [33]. Неғұрлым ірі бөлшектер, атап айтқанда, таблеткадағы немесе дражадағы ферменттік препараттар, ас химусы ОЕЕІ-те болмаған кезде тағам аралық кезеңде көшіріледі. Нәтижесінде препараттар тағаммен араласпайды және ас қорыту үрдісінде белсенді қатыспайды [8]. Егер таблетка немесе драже ұзақ уақыт бойы асқазанда болса, энтеросолюбильді қабық бұзылады,ал ішіндегі ферменттер әсерсіздендіріледі [1].
Бұл мәселені шешудің мүмкін нұсқаларының бірі фармакологиялық нарықта құрамында қышқылдан қорғайтын қабыққа мұқтаж емес, құрамында қышқылға төзімді өсімдік және саңырауқұлақ текті ферменттері бар препараттардың пайда болуы болып табылады. Алайда, саңырауқұлақ тектес қышқылға төзімді липазаны қолданудың тиімділігі панкреатин препараттарына айтарлықтай жеңіледі [40]. A. Suzuki et al деректері бойынша, бактериялық липаза иттердегі эксперименттерде шошқаларға қарағанда 75 есе аз тиімді болды- – стеатореяны 240 мг бактериялық ферменттің немесе 18 мг шошқа ферментінің тағайындалуымен жою мүмкін болды [41].
Ұйқы безінің липазасының тамақтан кейінгі ең жоғары физиологиялық түсуі тамақтан кейін 4 сағат ішінде шамамен 140 000 ӘБ/сағ-ты құрайтындықтан [13], ал егер аш ішекке ферменттің қалыпты ең жоғары өнімінің 5% - дан астамы түссе, мальабсорбция дамымайтын болса, онда, стеатореяны түзету үшін тамақтан кейінгі кезеңнің 4 сағаты ішінде шамамен 28 000 ӘБ липазаның түсуін қамтамасыз ету қажет. Қазіргі уақытта, ішіндегі липаза құрамы айтарлықтай қатты өзгеретін (0-25 000 ӘБ шегінде), әртүрлі полиферментті препараттардың көп саны бар. Тиісінше, стеатореяны түзету үшін липазаның жоғары мөлшері бар препараттарды ғана пайдалану қажет [15]. Алайда тәжірибеде ең жиі қолданылатындар, бір таблеткада (дражеде) 3500-6000 ӘБ шегінде липазасы бар коммерциялық қолжетімді препараттар болып табылады. Тиісінше, стеатореяны түзету үшін ең аз тиімді бір реттік мөлшер кем дегенде 5-8 драже немесе таблетка қабылдау болады. Алайда, бұл салыстырмалы есептеулер, өзінің көрсетімділігіне қарамастан, мұндай таблеткалардағы қолданылатын липазаның басым бөлігі препараттың толық емес фармакокинетикасына және химуспен бір мезгілде пассаждың мүмкін еместігіне байланысты әсерсіздендірілуі немесе белсендірілмеуі мүмкін екендігін ескермейді. Бұл жағдайда 5-8 таблетка туралы емес, дәлірек айтсақ - психологиялық себептер бойынша мүмкін емес, әрбір ас ішу үшін 20-30 таблетка туралы айту қажет. Осылайша, дәстүрлі қолданылатын экзогенді қабылданатын ферменттердің аз мөлшері, стеатореяны азайтатын болса да, неліктен оны ешқашан толығымен жоймайтыны түсінікті болады.
Сондықтан, панкреатиннің энтеросолюбильді таблеткалы полиферментті препараттарын, әсіресе дәстүрлі мөлшерлерде және ҰБ экзокринді жеткіліксіздігін емдеу үшін өсімдік тектес ферментті препараттарды қолдану іс жүзінде пайдасыз деген пікір даусыз болып табылады [18].
Ұйқы бездік ферменттердің қышқылдық әсерсіздендірілуіне қосымша липазаның әсерсіздендірілуіндегі протеолиттік ферменттердің рөлі зерттелді [15,37], алайда бұл механизмнің клиникалық мәні әлі күнге дейін дәлелденбеген. In vitro эксперименттерінде липазаның әртүрлі ұйқы бездік препараттармен тез әсерсіздендірілуі трипсиннің белсендіруімен өзара байланыстырылғандығы, ал трипсиннің оның тежегішімен тежелуі липазаның жұмыс істеу уақытын едәуір ұлғайтқаны көрсетілді [34]. Болжам бойынша, липазаның протеолитикалық әсерсіздендірілуі липазаның/трипсиннің физиологиялық деңгейіне қатысты арақатынасы ұлғайған кезде және, тамақта, әсіресе өсімдік тектес тамақ құрамында молшылықта болатын, субстрат ретінде де, трипсиннің табиғи тежегіштері есебінен де трипсинді байланыстыратын, панкреатиннің тағамдағы ақуызмен араласуының жақсаруы кезінде алдын алуы мүмкін [25]. Алкогольді СП бар пациенттерде протеазалар белсенділігінің дуоденальды шырынындағы липазаға арақатынасы трипсиннің және химотрипсиннің ұйқы бездік сөлдегі едәуір асып түсуіне байланысты жоғары. Бұл пациенттерде липазаның протеолитикалық әсерсіздендірілуі экзокринді жеткіліксіздіктің патогенезінде ҰБ қалыпты функциясына қарағанда аса маңызды. Алкогольді СП науқастарында ауырсынуды тоқтату үшін протеаздары жоғары ұйқы бездік ферменттер жиі қолданатынын атап өткен жөн, алайда, бұл кезде эндогенді липазаның әсерсіздендірілуі күшейтіледі [24,34,42]. Бұл факт әртүрлі жарияланымдарда жиі байқалады, онда СП науқастарындағы стеатореяны түзету тиімділігінің төмен себептері талданды [18,34,40,42].
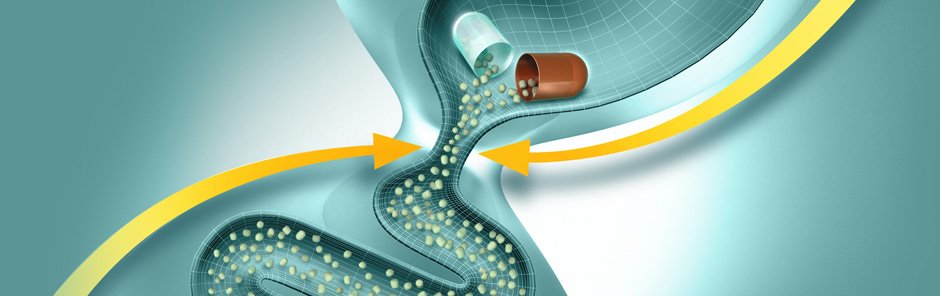
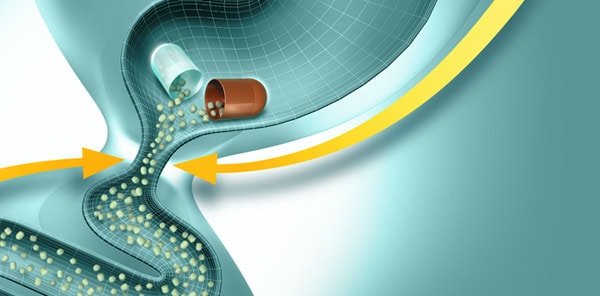
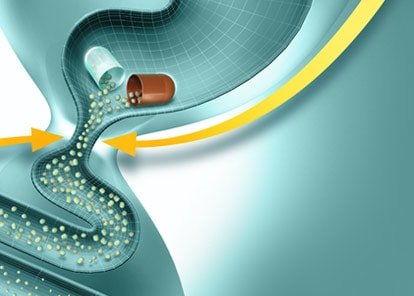
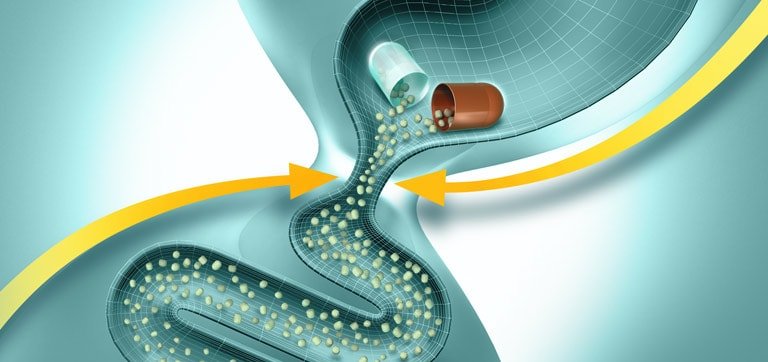
Ферменттердің тағамдық химуспен жылдам және гомогенді араластырылуын қамтамасыз ету үшін, асқазан ішілік әсерсіздендірілуді болдырмау және асқазаннан ОЕЕІ-ке барабар пассажды қамтамасыз ету үшін диаметрі 2 мм-ден аспайтын микротаблеткалар (панцитрат) және микросфералар (креон, ликреаза) түріндегі панкреатиннің жаңа буын ферменттік препараттары жасалды. Препарат энтеросолюбильді қабықпен жабылған және желатинді капсулаларға салынған. Асқазанға тиген кезде желатинді капсулалар тез ериді, микротаблеткалар тамақпен араласады және біртіндеп ОЕЕІ-ке түседі. Дуоденальды құрамның рН 5-тен жоғары болғанда қабықтар ериді және ферменттер үлкен бетте әрекет ете бастайды (1-сурет). Бұл ретте, ұйқы безінің шырыны асқазаннан тағамның мезгіл-мезгіл келіп түсуіне жауап ретінде бөлінген кезде ас қорытудың физиологиялық үрдістері іс жүзінде пайда болады.
Осылайша, микротаблеткаланатын және микрокапсуланатын препараттарды, оның ішінде, жоғарыда сипатталған, эксперименталды, теориялық, биохимиялық және клиникалық жұмыстар негізінде қалыптасқан осы препараттарға қойылатын заманауи талаптарға жауап беретін, алмастырушы ферментті терапияға арналған ең заманауи полиферментті препараттарға жатқызуға болады [1, 5, 7]:
препараттар жануар тектес болуы тиіс;
ферменттердің жеткілікті мөлшерінің болуы (бір ас ішуге липазаның құрамы 30000 ӘБ дейін);
энтеросолюбильді қабықтың болуы;
тамақпен біркелкі және жылдам араластыру;
ферменттердің тамақпен бір мезгілде ОЕЕІ-ке қалтқы арқылы пассажы;
аш ішектің жоғарғы бөлігінде ферменттердің жылдам босатылуы;
өт қышқылдарының болмауы.
қауіпсіздік, уыттылықтың болмауы.
Сондықтан, экзокринді жеткіліксіздігі бар СП-да бірінші таңдау препараттары ретінде Креон және Панцитрат препараттарын санауға болады. Кең қолданылатын Мезим-форте препаратын тәулігіне 3-6 таблетканың мөлшерінде тамақтанудағы қателіктер кезінде пайда болатын ҰБ дисфункциясын түзету үшін ғана пайдалануға болады. Ал сол кезде липаза белсенділігі 25 000 ӘБ болатын Креон препараттары ҰБ экзокринді функциясын толық алмастыра алады [10]. Панцитрат-бір капсулада трипсин мөлшері жоғары препарат (500-ден 1250 ӘБ-ке дейін). Бұл ретте, жоғарыда көрсетілгендей, протеаздар, ең алдымен, трипсин липазаның басты тежегіштері болып табылады. Липаза протеазасы жоғары препараттарда осы препараттағы протеаздармен қарқынды түрде бұзылатыны белгілі [7]. Бұл әсер экзокриндік жетіспеушілікті емдеу үшін панцитратты қолдануды біршама шектейді.
Тиісінше, жоғарыда көрсетілген талаптарды толық қанағаттандыратын және соңғы уақытта пайдаланылатын дәрілік зат энтеросолюбильді қабықпен қапталған минимикросфера (Креон 10000 және Креон 25000) түріндегі жоғары белсенді полиферментті препарат болып табылады. Бұл препарат, минимикросфералардың орташа мөлшері 1 мм-ге дейін кішірейтілгеніне байланысты, Креон 8000 және басқа өндірушілердің ұқсас препараттарынан әлдеқайда тиімді. Бұл микросфералар мен микротаблеткаларды қолданғаннан басқа фармакокинетиканы қамтамасыз етеді, тамақпен оңтайлы араласуға ықпал етеді және тиісінше препараттың тиімділігін орташа есеппен 25% - ға арттырады. Микросфералар өлшемін азайту шешімі,дені сау еріктілерге өткізілген экспериментте, асқазаннан ферментпен қабылданатын тағамның мөлшеріне қарамастан диаметрі 1 мм микросфералар тез көшірілгенін көрсеткен, J. H. Meyer et al зерттеу нәтижелеріне сүйенеді [33].
Полиферментті терапияның жанама әсері жиі емес және әдетте ауыр сипатқа ие болмайды. Осыған қатысты ең көрнекілері, сау еріктілерде 4 апта бойы липолитикалық белсенділіктің 360 000 (!) ӘБ тәуліктік мөлшерінде панкреатинді қабылдаған H.Friess және авторластардың зерттеулері болды. Авторлармен ҰБ экзо - және эндокриндік функциясының адаптациялық өзгерістері, оның өлшемдерінің өзгеруі табылған жоқ, сонымен қатар айтарлықтай жанама әсерлері байқалған жоқ [20], бұл тағы да панкреатин препараттарын айтарлықтай қауіпсіз деп сипаттайды.
Полиферментті препараттарды қабылдағанда пайда болатын сирек ықтимал жанама әсерлерге келесілерді жатқызуға болады [7]: ауыз қуысындағы ауырсыну сезімдері; перианальды аймақтағы терінің тітіркенуі; іштегі жайсыздық; гиперурикемия; аллергиялық реакциялар; фолий қышқылының сіңуінің бұзылуы (кешендердің түзілуі). Полиферментті препараттардың өте жоғары мөлшерлерін ұзақ қабылдағанда туындайтын ең ауыр асқыну-ішектің терминалды бөлігінің фиброзы және тоқ ішектің оң бөлігінің фиброзы немесе фиброзды колонопатия.
Оның патогенезі әлі күнге дейін белгісіз болса да, бұл нозологияның пайда болуы күніне 1 кг салмаққа 50000 ӘБ липазадан асатын полиферментті препараттардың жоғары мөлшерлерін ұзақ қабылдаумен байланысты [12]. Осы өзара байланысты орнатқанға дейін барлық елдер бойынша барлығы 60-қа жуық жағдай тіркелді. Фиброзды колонопатия көбінесе метеоризм және ауырсыну абдоминальды синдроммен көрінеді, рентгенограммаларда ішек қабырғасының қалыңдауы және ішек саңылауының тарылуы анықталады. Биопсия кезінде жетілген фиброзды тіннің шырышты қабатындағы айқын өсуі анықталады. Бұл емқателік асқыну көптеген полиферментті препараттардың энтеросолюбильді қабықшаларының компоненттері болып табылатын метакрил қышқылының кополимерлерімен байланысты болып табылады деп саналады. Креонда ішекте еритін қабығы гидроксипропилметилцелюлозадан тұратындықтан, оны қабылдау біршама қауіпсіз болып табылады [35].
Алмастырушы ферменттік терапия стратегиясы.
ҰБ сыртқы секреторлы жеткіліксіздігін емдеу кешенді сипатқа ие және өзіне тән нутритивті түзетуді, экзокриндік жетіспеушіліктің этиотропты және орнын басатын терапияны, сондай-ақ симтоматикалық дәрілерді қамтиды. ҰБ сыртқы секреторлық жетіспеушілігімен СП этиотропты терапиясы СП кейбір этиологиялық нысандарында ғана маңызды. Бұл, ұйқы бездік жеткіліксіздіктің дамуы кезінде жұмыс істеп тұрған ҰБ экзокринді паренхимасының 90% - ға дейін жоғалуының орын алуымен негізделеді және этиотропты терапия негізінен қалған функционалдық паренхиманың, әсіресе ҰБ эндокриндік аппаратының барынша сақталуымен аурудың өршуін болдырмауға бағытталған. Емге этиотропты тәсілдердің классикалық мысалдары - алкогольді СП науқастарында алкогольді қабылдауды болдырмау, аутоиммунды СП кезінде кортикостероидтармен емдеу болып табылады. Өт-тас ауруларымен, фатер емізігінің вентильді конкременттерімен, Одди қысқышының тыртықты стенозымен және обструктивті СП басқа түрлерімен ауыратын науқастарда операциялық емдеу жүргізілуі мүмкін. СП дамуының басқа да себептеріне қатысты этиотропты терапия әзірленбеген немесе аурудың осы сатысында тиімді емес.
Нутритивті қолдау жалпы сипаттағы ұсынымдардан қалыптасады: аурудың этиологиясына қарамастан алкоголь мен темекі шегуді болдырмау, рациондағы ақуыздың жоғары мөлшері (тәулігіне 150 г дейін), тағамдағы майлар мөлшерінің нормадан 50%-ға төмендеуі. Көбінесе орташа тізбекті триглицеридтер, моно - және полиқанықпаған май қышқылдары ұсынылады, олар ұйқы бездің липазасымен қорытылады және мицелл түзілместен сіңеді. Тағам рационы дәрумендермен байытылған, ең алдымен май еритіндермен. Витаминдер мен антиоксиданттық қасиеттері бар микроэлементтердің жоғары мөлшерлері бар витаминді-минералды кешендерді қабылдау ұсынылады. Трофологиялық жеткіліксіздігі бар науқастарда жағдайдың ауырлығына байланысты парентеральды, энтеральды немесе аралас тамақтану тағайындалады.
Сыртқы секреторлы жеткіліксіздігі бар СП-да ферменттік препараттар өмір бойы тағайындалады, алайда, мөлшері көптеген факторларға байланысты өзгеруі мүмкін, соның ішінде науқастың диетаны сақтауына. Осылайша, ферментті препараттың мөлшерін таңдау туралы шешім әрбір науқас үшін жеке қабылдануы тиіс. Препараттың құрамына кіретін ферменттер белсенділігінің концентрациясын таңдау кезінде, құрамының төмендеуі ҰБ экзокриндік жеткіліксіздігінің айқын көрінуін көрсететін, фекальды эластаза белсенділігінің деректерін басшылыққа алуға болады деп есептейміз. Эластазды сынақ қазіргі уақытта ҰБ сыртқы секреторлық жеткіліксіздігін диагностикалаудың инвазивті емес әдістерінің ең ақпараттысы болып табылады және сонымен қатар ол кең қол жетімді болып келеді. СП науқастарында полиферментті препараттың мөлшерін таңдау әдістемесі қолданылған бірқатар зерттеулер мөлшерді бастапқы таңдау кезінде фекальді эластаза деңгейіне бағдарланудың клиникалық мақсаттылығын көрсетті [5,6]. Сыртқы секреторлық жетіспеушіліктің эластазды сынақ мәліметтері бойынша диагностикаланған деңгейге байланысты, дифференцияланған полиферментті терапия тағайындалады (2-кесте). Кестелік деректерге сәйкес, ҰБ қалыпты экзокринді функциясы бар СП науқастарына диспепсия симптомдарын түзету мақсатында, метеоризм және ауырсынатын абдоминальды синдром кезінде тәулігіне кемінде 50 000 ӘБ липазалық белсенділік мөлшерінде панкреатиннің қазіргі заманғы препараттарын курстық қабылдауды тағайындауға болады. Экзокриндік жеткіліксіздігі бар науқастарға полиферментті препараттардың біршама жоғары бастапқы мөлшерлері ұсынылады.
2-кесте.
Фекальды эластазаның деректеріне сәйкес СП науқастарында полиферментті препараттың мөлшерін* таңдау бойынша ұсынымдар
ҰБ экзокриндік функциясының жағдайы
Нәжіс эластазасының деректері (мкг/г)
Препараттың ұсынылатын мөлшері ЕД FIP липаза тәулігіне
ҰБ қалыпты экзокринді функциясы
200-ден астам
50 000
Орташа айқындалған экзокринді жеткіліксіздігі
100-199
100 000
Айқын экзокринді жеткіліксіздігі
100-ден кем
150 000
Ескертпе: * тек энтеросолюбильді қабықтағы панкреатиннің микрокапсулаланған препараттары үшін.
Сыртқысекреторлы жетіспеушілігі бар созылмалы панкреатитпен ауыратын науқастардың көпшілігі жиі бөлшек қоректендірудің ұсынымдарын ұстана отырып, диетаны сақтайды, оларда, әдетте, тағамның барлық тәсілдері бірдей және 2-кестеде көрсетілген схема бойынша ферменттерді қабылдауға болады. Егер пациенттің диетасы дәстүрлі 3 тамақтану және 2-3 аралық тамақтардан тұрса, онда, ҰБ экзокриндік жетіспеушілігінің дәрежесіне байланысты креонды негізгі тамақтануға липазаның 36 000 ӘБ дейін және аралық тамақтануға 10 000-20000 ӘБ қабылдау ұсынылады. Ең жоғары әсерге қол жеткізу үшін ферментті препараттар тағамның ең басында және мүмкіндігінше тамақтану кезінде фракциялы түрде қабылдануы тиіс (1 капсуладан артық қабылдағанда).
Алмастыру терапиясына арналған ферментті препаратты және оның бастапқы мөлшерін дұрыс таңдауына қарамастан, соңғысы оның ықтимал тиімсіздігіне байланысты, сондай – ақ оның тиімділігі кезінде терапияның неғұрлым үнемді схемасына қол жеткізу үшін тәуліктік мөлшерді азайтуға әрекет ету мақсатында түзетуге тура келеді. Бұл үшін науқастар препараттарды қабылдау тәртібі туралы егжей - тегжейлі нұсқау алуы тиіс, өйткені дәрілік заттардың оңтайлы әсерін қамтамасыз ету үшін пациенттер тарапынан белгілі бір күш-жігер қажет - оларға берілген ұсынымдарды нақты орындау. Сондықтан соңғы уақытта комплайнсқа қол жеткізуге үлкен мән беріледі – дәрігер мен пациенттің жақсы бірлескен жұмысы. Экзокриндік жеткіліксіздігі бар СП науқастарға полиферментті препараттарды тағайындау алгоритмі 2-суретте көрсетілген.
Клиникалық айқын көрінген ұйқы бездік жеткіліксіздік кезінде әдетте препараттардың жоғары мөлшерлерінің көмегімен де стеатореяны толығымен жоюға болмайды, сондықтан ас қорыту ферменттерінің таңдалған мөлшерінің барабарлығының өлшемі дене салмағының артуы, нәжістің қалыпқа келуі (күніне 3 реттен аз), метеоризмнің азаюы болып табылады.
2-сурет. Алмастыру терапиясының алгоритмі.

Алмастырушы ферменттік терапияның тиімсіздігінің себептері келесідей болуы мүмкін:
- дұрыс емес қойылған диагноз;
- мальабсорбция синдромын ауырлататын және арнайы емдеуді қажет ететін (целиакия, ішектің қабыну аурулары, тиреотоксикоз, үшек құрт инвазиялары және т. б.) СП ілеспелі патологиясының болуы;
- асқазан секрециясының бұғаттаушыларынсыз қышқылдан қорғайтын қабығы жоқ (Киршнердің панкреалы) панкреатин препараттарын тағайындау;
- энтеросолюбильді қабықта (асинхронды гастродуоденалдық тасымал) панкреатиннің таблеткаланған препараттарын тағайындау;
- перистальтиканы күшейтетін және осмотикалық іш өтуді тудыратын өт бар препараттарды тағайындау;
- емдеудің жалпы құнын төмендету үшін ферменттердің (оның ішінде микрокапсулаланған) барабар емес төмен мөлшерлерін тағайындау;
- комплайнстің бұзылуы (емдәмдегі бұзылулар, полиферментті препараттарды қабылдау мөлшерінің, уақыты мен еселігінің ерікті өзгеруі)
- қайталама ұйқы бездік жеткіліксіздікке әкелетін ықтимал тетіктердің шала есептелмеуі (ОЕЕІ ацидификациясы бар асқазан гиперсекциясы, бауыр циррозы, артық бактериялық өсу синдромы, гипермоторлы ішек бұзылыстары, постгастрорезекциядан кейінгі бұзылулар және т. б.).
ҰБ сыртқы секреторлық жеткіліксіздік синдромы бар науқастардың бөлігінде, ішектің перистальтикасын әлсірететін препараттарды (имодиум, дюспаталин және т.б.) тағайындауды талап ететін іштегінің ішектегі транзиті тездетілген. Симптоматикалық мақсаттармен тұтқырлататын және бүркеуіш препараттардың қысқа курстары қолданылуы мүмкін. Ішектің моторикасы қант диабетімен ауыратын науқастарда және ваготомияға шалдыққан пациенттерде (өкінішке орай, СП бар пациенттердегі екі жағдай да сирек емес) өте жиі бұзылғанын есте сақтаған жөн, сонымен қатар, алмастырушы полиферментті терапияның тиімділігін төмендететін, артық бактериялық өсу синдромы жиі кездеседі [32]. Сондықтан экзокринді жеткіліксіздікті барынша барабар емдеу үшін ішек микробиоценозының (про - және пребиотиканың) бұзылуын жоятын препараттарды емдеу кешенінің құрамына міндетті түрде қосу қажет деп саналады [9]. Пробиотиктерге қарағанда өзіндік микрофлораның өсуін ынталандыратын пребиотикалық қасиеттері бар препараттарға артықшылық беру керек, бұл ағзаға артық антигендік жүктеме тудырмайды [2].
Бұған дейін атап өткендей, интрадуоденальды рН төменгі мәндері алмастыру мақсатында қабылданатын полиферментті препараттардың әсерсіздендірілуіне алып келеді. рН 4-тен аз интрадуоденальды мәндерінде Креон микросферасын қабылдаған жағдайда да энтеросолюбильді қабықшаның еруі тек ішектің проксимальды бөлімінде ғана болады, бұл мальдигестияны барабар түзетуге әкелмейді. Бұдан басқа, дуоденальді pH төмен мәндерінде өт қышқылдары мицеллінің мен липидтердің концентрациясы азаяды,бұл өт қышқылдарының преципитациясын тудырады, тіпті ҰБ экзокринді жеткіліксіздігі бар пациенттерде өт перпрандиальды секрециясы қалыпты болғанда да. Сондықтан ферменттердің ең жоғары терапевтік әсеріне жету үшін оларды қабылдауды антацидтермен, гистамин H2-рецепторларының блокаторларымен немесе протонды сорғы тежегіштерімен біріктіру ұсынылады, бұл препараттардың мөлшерлері мен қабылдау режимі жеке іріктеледі. Бұл препаратты қолдану аясында стеатореяның толық редукциясына сирек қол жеткізіледі, бірақ асқазан және дуоденальді pH мәні 5 деңгейінде ұзақ уақыт бойы қолдау тапты [37]. Егер гистамин Н2-рецепторларының блокаторлары стеаторияны басуда тиімді болмаған жағдайда, қазіргі уақытта ҰБ сыртқы секреторлық жеткіліксіздігінің кешенді терапиясында өзін жақсы көрсете алған [4, 17, 39], протонды сорғы тежегіштерін қолдану көрсетіледі [21]. E. P. DiMagno деректері бойынша стеатореяға қатысты алмастырушы ферменттік терапия тиімсіз болған жағдайда (тамақтануға липазаның 90 000 ӘБ дейін қабылдауы), кешенді терапияға омепразолды енгізу майлардың сіңуін 40%-ға арттырады [17]. Біздің мәліметтеріміз бойынша [4] жоғары мөлшерлерде креонмен емдеуге резистентті, ауыр дәрежедегі ҰБ сыртқы секреторлы жеткіліксіздігі бар науқастарда протонды сорғының қазіргі заманғы тежегіші – рабепразол жеткілікті тиімді болды, оның тағайындалуы 70% - дан астам науқастарда стеатореяның, диареялық синдромның және метеоризмнің редукциясына алып келді, оның үстіне пациенттердің бір бөлігінде полиферментті препараттың мөлшерлері азайтылды.
Қорытындылай келе, экзокринді ұйқы бездік жетіспеушілікті емдеу күрделі мәселе болып қалатынын, кешенді тәсілді талап ететіндігін атап өткен жөн; консервативті емдеу схемасын таңдау кезінде экзокринді және трофологиялық жеткіліксіздік дәрежесін, ауырсыну абдоминальды синдром мен эндокриндік бұзылулардың айқындылығын ескере отырып, әрбір жеке алынған жағдайда жеке тәсіл қажет. Соңғы жылдары әзірленген ферменттік препараттардың, протеаз бен липазаның олардың субстраттарына тікелей араласуы мен сегрегациясын айтарлықтай жақсартатын, галениялық нысандары, ұйқы бездік жеткіліксіздік кезінде алмастыру терапиясының сапасын едәуір арттырады. Препаратты асқазандағы тұз қышқылынан қорғайтын қабықпен қапталған таблеткаланған полиферментті препараттарды қолдану іс жүзінде пайдасыз; тек энтеросолюбильді қабықпен қапталған панкреатиннің минимикросфералары бар соңғы ұрпақтың препараттары стеатореяны анық және мөлшерге тәуелді азайтады. Дәрігер алмастырушы ферменттік терапия принциптерін білуі тағайындалған емнің барабарлығын және ауру ағымының болжамын анықтайды.
.Әдебиет
Белоусова Е.А., Златкина А.Р., Морозова Н.А., Тишкина Н.Н. Гастроэнтерологияда ферментті препараттарды қолданудың ескі және жаңа аспектілері // Фарматека. – 2003. - №7. –39-44-беттер.
Гриневич В.Б., Богданов И.В., Саблин О.А. Полиферментті алмастыру терапиясының клиникалық және фармакоэкономикалық аспектілері // Клин. перспект. гастроэнтерол., гепатол. – 2004. - №2. –16-23-беттер.
ДиМагно Е.П. Физиологиялық жағдайларда және патология кезінде адамда ас қорыту аралық және ынталандырылған экзокринді ұйқы бездік секреция және оның бұзылуының салдары // Физиология и патофизиология желудочно-кишечного тракта / Дж. М. Полак, С. Р. Блум, Н.А. Райт, А. Г. Батлер редакциясы астында; Ағылшын тілінен аударма – М.: Медицина, 1989. –302-321-беттер.
Кучерявый Ю.А. Ауыр сыртқы секреторлы жеткіліксіздігі бар созылмалы панкреатит кезінде біріктірілген антисекреторлық және полиферменттік терапияның тиімділігін бағалау // Рос. журн. гастроэнтерол., гепатол., колопроктол. – 2004. - №2. –78-83-беттер.
Маев И.В., Кучерявый Ю.А. Гастроэнтерологиялық практикадағы полиферментті препараттар // Врач. – 2003. - №10. – 59-61-беттер.
Маев И.В., Кучерявый Ю.А. Созылмалы билиарлық тәуелді панкреатит кезінде энтеросолюбильді қабықта полиферментті препараттармен мөлшерге тәуелді терапия // Врач. – 2003. - №12. – 35-38-беттер.
Охлобыстин А.В. Гастроэнтерологияда ас қорыту ферменттері препараттарын қолдану // Клин. перспект. гастроэнтерол., гепатол. – 2001. – №2. –34-38-беттер.
Саблин О.А., Бутенко Е.В. Гастроэнтерологиядағы ферменттік препараттар // Consilium medicum. – 2004. – Прил.№1 (Гастроэнтерология). –11-17-беттер.
Старостин Б.Д. Созылмалы панкреатиттің аралас терапиясы (қос соқыр плацебо-бақыланатын сынамалы зерттеу)// Эксп. и клин. гастроэнтерол. – 2003. - №3. –58-65-беттер.
Щербаков П.Л. Ұйқы безі аурулары кезіндегі ферментті препараттар // Клин. мед. – 2001. - №11. –71-74-беттер.
Atkinson S.N. A comparative study of the enzyme activity, acid resistance and dissolution characteristics of four enteric coated microsphere preparations of pancreatin // Eur. J. Clin. Res. - 1991. - Vol.1. – P.37-45.
Bansi D.S., Price A., Russell C., Sarner M. Fibrosing colonopathy in an adult owing to over use of pancreatic enzyme supplements // Gut. – 2000. - Vol. 46 (2). – P.283-285.
DiMagno E.P., Go V.L.W., Summerskill W.H.J. Relationship between pancreatic enzyme output and malabsorption in severe pancreatic insufficiency // N. Engl. J. Med. – 1973. – Vol.288. – P.813-815.
DiMagno E.P., Malagelada J.R., Go V.L.W. Relationship between alcoholism and pancreatic insufficiency // Ann. NY Acad. Sci. – 1975. - Vol.252. – P.200-207.
DiMagno E.P., Malagelada J.R., Go V.L.W. et al. Fate of orally ingested enzymes in pancreatic insufficiency: comparison of two dosage schedules // N. Engl. J. Med. – 1977. - Vol.296. – Р.1318.
DiMagno E.P., Clain J.E., Layer P. Chronic pancreatitis. – In: Go V.L.W. et al. The Pancreas: Biology, Pathobiology, and diseases. – New York: Raven Press, 1993. – Р.665-706.
DiMagno E.P. Gastric acid suppression and treatment of severe exocrine pancreatic insufficiency // Best Pract. Res. Clin. Gastroenterol. – 2001. - Vol. 15 (3). – P.477-486.
Dobrilla G. Management of chronic pancreatitis. Focus on enzyme replacement therapy // Int. J. Pancreatol. – 1989. - Vol.5. – Р.17-29.
Dutta S., Hubbard V., Appler M. Critical evaluation of the therapeutic efficacy of a pH sensitive enteric-coated pancreatic enzyme preparation in the treatment of exocrine pancreatic insufficiency secondary to cystic fibrosis // Dig. Dis. Sci. – 1988. - Vol.33. – Р.1237-1244.
Friess H., Kleeff J., Malfertheiner P. et al. Influence of high-dose pancreatic enzyme treatment on pancreatic function in healthy volunteers // Int. J. Pancreatol. – 1998. - Vol. 23 (2). – P.115-123.
Heijerman H.G., Lamers C.B., Bakker W. Omeprazole enhances the efficacy of pancreatin (pancrease) in cystic fibrosis // Ann. Intern. Med. – 1991. - Vol.114. – Р.200.
Ihse I., Arnesjoe B., Kugelberg C. et al. Intestinal activities of trypsin, lipase and phospholipase after a test meal. An evaluation of 474 examination // Scand. J. Gastroenterol. – 1977. - Vol.12. – Р.663-668.
Ihse I., Lilja P., Lundquist I. Intestinal concentrations of pancreatic enzymes following pancreatic replacement therapy // Scand. J. Gastroenterol. – 1980. - Vol.15. – Р.137-144.
Isaksson G., Ihse I. Pain reduction by an oral pancreatic enzyme preparation in chronic pancreatitis // Dig. Dis. Sci. – 1983. - Vol.28. – Р.97-102.
Kelly D.G., Bentley K.J., Sandberg R.J. et al. Do nutrients and bile in human duodenal juice effect the survival of lipase activity? Possible clinical implications // Gastroenterology – 1988. - Vol.94. – A.222.
Lankisch P.G., Creutzfeldt W. Therapy of exocrine and endocrine pancreatic insufficiency. – In Creutzfeldt W., ed. Clinics in Gastroenterology. – Philadelphia: W.B. Saunders, 1984. – Р.985-999.
Lankisch P.G., Buchler M., Mossner J. A primer of pancreatitis. – Berlin: Springer- Verlag, 1997.
Layer P., Go V.L.W., DiMagno E.P. Fate of pancreatic enzymes during small intestinal aboral transit in humans // Am. J. Physiol. – 1986. - Vol.251. – P.475-480.
Layer P., Zinsmeister A., DiMagno E.P. Effects of decreasing intraluminal amylase activity on starch digestion and postprandial gastrointestinal function in humans // Gastroenterol. – 1986. - Vol.91. – P.41-48.
Layer P., Jansen J., Cherian N. et al. Feedback regulation of human pancreatic secretion // Gastroenterol. – 1990. - Vol.98. – P.1311-1319.
Legg E.F., Spencer A.M. Studies on the stability of pancreatic enzymes in duodenal fluid to storage temperature and pH // Clin. Chim. Acta. – 1975. - Vol.65. – P.175-179.
Madsen J.L., Graff J., Philipsen E.K. et al. Bile acid malabsorption or disturbed intestinal permeability in patients treated with enzyme substitution for exocrine pancreatic insufficiency is not caused by bacterial overgrowth // Pancreas. – 2003. - Vol. 26 (2). – P.130-133.
Meyer J.H., Elashoff J., Porter-Fink V. et al. Human postprandial gastric empting of 1-3 millimeter spheres // Gastroenterol. – 1988. – Vol.94. – P.1315-1325.
Pap А, Varrо V. Proteolytic inactivation of lipase as a possible cause of the uneven results obtained with enzyme substitution in pancreatic insufficiency // Hepatogastroenterol. – 1984. - Vol.31. – Р.47-50.
Pounder R.E. Pancreatic enzyme supplements and fibrosing colonopathy. In: J.K. Aronson (Ed.). Side Effects of Drug Annual 20. – 1997. - Chapter 36. – Р.322.
Regan P.T., Malagelada J.R., DiMagno E.P. et al. Comparative effects of antacids, cimetidine and enteric coating on the therapeutic response to oral enzymes in severe pancreatic insufficiency // Dig. Dis. Sci. – 1982. - Vol.27. – Р.485-490.
Regan P.T., Malagelada J.R., DiMagno E.P. et al. Comperative effects of antacids, cimetidine, and enteric coating on the therapeutic response to oral enzymes in severe pancreatic insufficiency // N. Engl. J. Med. – 1977. - Vol.297. – Р.854-858.
Regan P.T., Malagelada J.R., DiMagno E.P., Go V.L.W. Reduced intraluminal bile acid concentrations and fat maldigestion in pancreatic insufficiency: correction by treatment // Gastroenterol. – 1979. - Vol.77. - P.285-289.
Sarner M. Treatment of pancreatic exocrine deficiency // World J. Surg. – 2003. - Vol.27(11). – P.1192-1195.
Schneider M.U., Knoll-Ruzicka M.L., Domschke S. et al. Pancreatic enzyme replacement therapy: comparative effects of conventional and enteric-coated microspheric pancreatin and acid stable fungal enzyme preparations on steatorrhea in chronic pancreatitis // Hepatogastroenterol. –1985. – Vol.32. – Р.97-102.
Suzuki A., Mizumoto A., Rerknimitr R. et al. Effect of bacterial or porcrine lipase with low- or high-fat diets on nutrient absorption in pancreatic-insufficient dogs // Gastroenterol. – 1999. – Vol. 116 (2). – P.431-437.
Thiruvengadam R., DiMagno E.P. Inactivation of human lipase by proteases // Am. J. Physiol. – 1988. - Vol.255. – Р.476-481.
Worning H. The effect of enzyme substitution in patients with pancreatic insufficiency // Scand. J. Gastroenterol. – 1980. - Vol.15. – Р.529-533.
Zentler-Munro P.L., Fitzpatrick W.J.F., Batten J.C., Northfield T.C. Effect of intrajejunal acidity on aqueous phase bile acid and lipid concentrations in pancreatic steatorrhea due to cystic fibrosis // Gut. – 1984. - Vol.25. - P.500-507.
Zentler-Munro P.L., Northfield T.C. Review: pancreatic enzyme replacement – applied physiology and pharmacology // Aliment. Pharmacol. Ther. – 1987. - Vol.1. - P.575-592.